Chlorameisensäuremethylester
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Methylchlorformiat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C2H3ClO2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit stechendem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 94,5 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[2] | ||||||||||||||||||
| Dichte |
1,22 g·cm−3 (20 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
72 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,3868 (20 °C)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Chlorameisensäuremethylester ist eine organisch-chemische Verbindung aus der Stoffgruppe der Chlorameisensäureester (eigentlich korrekterweise Chlorkohlensäureester), die als Zwischenprodukt zur Herstellung verschiedener Kohlensäure-Derivate dient.
Nomenklatur
[Bearbeiten | Quelltext bearbeiten]Der gebräuchliche Name „Chlorameisensäuremethylester“ ist nicht korrekt, da die Verbindung kein Derivat der Ameisensäure, sondern der Kohlensäure (Kohlensäuremonochlorid und Kohlensäuremonoester) ist.[7]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Chlorameisensäuremethylester wird technisch in einem kontinuierlichen Prozess aus Phosgen und wasserfreiem Methanol bei Temperaturen bis 10 °C hergestellt.[8]
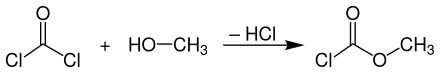
Die Umsetzung kann im Gleich- oder Gegenstrom erfolgen. Beim Gleichstromverfahren wird in Rührkesselreaktoren, Reaktoren mit eingebauter Zerstäuberdüse oder Umlaufreaktoren gearbeitet, wohingegen man für die Gegenstromanordnung in der Regel eine Füllkörperkolonne verwendet, bei der überschüssiges Phosgen zusammen mit gasförmigem Chlorwasserstoff am Kopf der Kolonne austritt und der Chlorameisensäuremethylester im Sumpf angereichert wird.[8]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Chlorameisensäuremethylester hydrolysiert mit Wasser langsam zu Methanol, Chlorwasserstoff und Kohlendioxid.[3] Mit Wasserdampf verläuft die Hydrolyse heftig unter Zersetzung und Aufschäumen. In Hitze zersetzt sich die Verbindung, wobei Chlorwasserstoff, Phosgen, Chlor und andere giftige Stoffe frei werden können.[2]
Sicherheitstechnische Kenngrößen
[Bearbeiten | Quelltext bearbeiten]Chlorameisensäuremethylester bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei 10 °C.[2][9] Der Explosionsbereich liegt zwischen 7,5 Vol.‑% (293 g/m3) als untere Explosionsgrenze (UEG) und 26 Vol.‑% (1020 g/m3) als obere Explosionsgrenze (OEG).[2] Die Grenzspaltweite wurde mit 1,2 mm bestimmt.[2][9] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[2] Die Zündtemperatur beträgt 475 °C.[2][9] Der Stoff fällt somit in die Temperaturklasse T1.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Chlorameisensäuremethylester dient als weit verbreitetes Zwischenprodukt bei der Herstellung von Carbonaten und Carbamaten,[10] Farb- und Arzneistoffen, den Pflanzenschutzmitteln Asulam, Benomyl, Carbendazim, Hexazinon, Phenmedipham, Pyrazosulfuron-ethyl, Thiophanat-methyl, Triflusulfuron-methyl, von zinkorganischen Reagenzien mit Hilfe von elektrochemischen Methoden und als wasserentziehendes Mittel bei der Herstellung von 2-Hydroxybenzonitril.
Verwandte Verbindungen
[Bearbeiten | Quelltext bearbeiten]- Chlorameisensäureethylester
- Chlorameisensäure-n-butylester
- Chlorameisensäurebenzylester
- Chlorameisensäurephenylester
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Datenblatt Chlorameisensäuremethylester bei Merck, abgerufen am 2. Mai 2014.
- ↑ a b c d e f g h i j k l m n o p q r Eintrag zu Methylchlorformiat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ a b c Toxikologische Bewertung von Chlorameisensäuremethylester (PDF) bei der Berufsgenossenschaft Rohstoffe und chemische Industrie (BG RCI), abgerufen am 2. Mai 2014.
- ↑ W. M. Haynes (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-364.
- ↑ Eintrag zu Methyl chloroformate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 79-22-1 bzw. Chlorameisensäuremethylester), abgerufen am 2. November 2015.
- ↑ Eberhard Breitmaier, Günther Jung: Organische Chemie. Grundlagen, Stoffklassen, Reaktionen, Konzepte, Molekülstruktur. 5. Auflage. Georg Thieme Verlag, Stuttgart 2005, ISBN 3-13-541505-8, S. 430 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Siegfried Böhm, Maren Beth-Hübner: Chloroformic Esters. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley‐VCH Verlag GmbH & Co. KGaA., 15. April 2006, doi:10.1002/14356007.a06_559.pub2.
- ↑ a b c E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- ↑ chemicalland21.com: METHYL CHLOROFORMATE, abgerufen am 2. Mai 2014.


